最も単純な分子軌道法
物理化学演習のレポートを溜めていたせいで馬車馬の如くシュレーディンガー方程式を解かされています。その中に懐かしいものがあったので書き留めておきます。
共有結合の化学結合力が何に由来するかを考えるとき、原子軌道の線形結合で構成される分子軌道(LCAO-MO)を用いてよく説明されます。物理化学の教科書でよく見る奴ですね。
高1で始めて"まともな化学"に触れたときに先輩にこれを教わったのですが、定性的な議論に留まってたので定量的に吟味していきましょう。最も単純な二原子モデルである水素分子イオン(H2+)を使います。水素原子の距離をRとしてそれぞれの1s軌道を原子単位を用いて式で表すと、
そこで、分子軌道の試行関数を次のようにすると、変分法の手続きにより
となる。αはクーロン積分、βは共鳴積分、Sは重なり積分でそれぞれRの関数である。これを横軸Rのグラフに起こすと次のようになる。

詳しい計算は省略するが、赤色のグラフで表されるエネルギーには次のψ1、青色の方はψ2が対応する(ただし規格化されていない)。
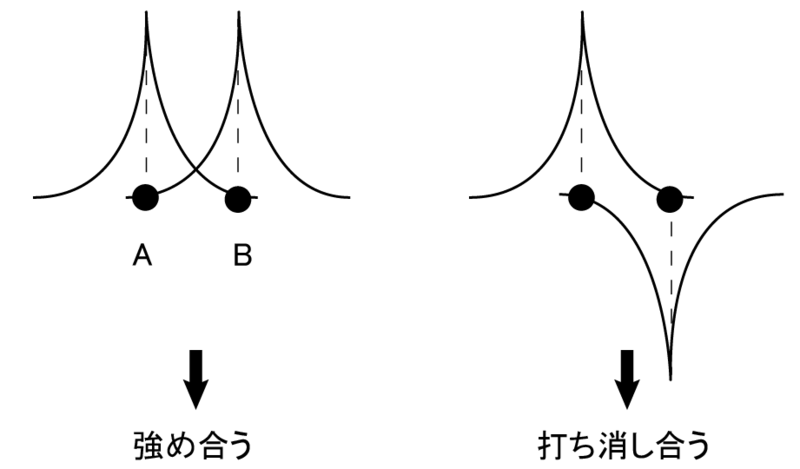
前者を結合性軌道、後者を反結合性軌道とよぶ。適切な結合距離(この場合はR=2.5)を考えると、結合性軌道のエネルギーが極小値を取り、最も安定となる。そこで、R=2.5の場合にそれぞれの軌道をグラフ化してみる。
結合性軌道では原子核間に電子が分布しているが、反結合性軌道ではR=0において節が存在することがわかる。
定量性を吟味するつもりでしたが、クーロン積分や共鳴積分の計算をだらだらとここに書くわけにも行かなかったので結果のグラフを載せるだけになってしましました。単純なモデルでも実際に計算してそれなりに意味のある結果が出ると達成感がありますね。
まあ、大学入試の積分問題よりはやる気が出る…程度でしょうけど。




